SMC 資料庫
議題背景:
國立陽明交通大學臨床醫學研究所教授楊慕華的研究團隊,在今(2023)年4月7日發表一篇於《先進科學》(Advanced Science)期刊的研究〈Ferroptosis Signature Shapes the Immune Profiles to Enhance the Response to Immune Checkpoint Inhibitors in Head and Neck Cancer〉發現,誘導頭頸癌細胞「鐵凋亡」(ferroptosis)可提升腫瘤的免疫治療效果。
此篇研究發現一種新的潛在癌症治療方法,主要是透過誘導癌細胞的鐵凋亡(Ferroptosis)機制,能引起頭頸癌細胞(HNSCC)出現發炎的微環境與PDL-1的表現,從而有效提高免疫治療的效果。研究結論認為,這一發現具有提高免疫治療成功率的潛力,將有助於未來發展出新的治療策略。
專家表示,目前腫瘤的免疫治療上,單以腫瘤細胞PD-L1的免疫反應來篩選病人仍不夠準確,但此研究結果顯示,未來可以更精確的篩選出適合免疫治療合併鐵凋亡治療的病人,這是非常好的一個突破。不過專家也提到,如何使癌細胞成為抗原呈現細胞而引發免疫反應,同時維持腫瘤微環境中免疫細胞的正常功能,是當前急需解決的問題。未來也需要更進一步的研究,以更精確評估進入臨床試驗的潛力。
引用研究:
- Chung, C.-H., Lin, C.-Y., Chen, C.-Y., Hsueh, C.-W., Chang, Y.-W., Wang, C.-C., Chu, P.-Y., Tai, S.-K., Yang, M.-H., Ferroptosis Signature Shapes the Immune Profiles to Enhance the Response to Immune Checkpoint Inhibitors in Head and Neck Cancer. Adv. Sci. 2023, 2204514. https://doi.org/10.1002/advs.202204514
專家怎麼說?
2023年05月06日
國立成功大學醫學院藥理學研究所講座教授 王憶卿
- 這份研究的重要性為何?
楊慕華研究團隊以頭頸癌患者樣本利用多種轉錄體研究發現鐵凋亡信號和促進腫瘤免疫活化的信號呈正相關性,進一步以細胞、動物與臨床實驗,證明了鐵凋亡可以促進免疫調節分子PD-L1基因轉錄表現而造成抗腫瘤免疫微環境以抑制癌組織生長。
該研究最後一張圖中所示的癌組織4-HNE鐵凋亡標誌物再加上腫瘤細胞與免疫細胞(如樹突細胞和巨噬細胞)中的PD-L1表現,可以更精確地篩選出適合免疫治療合併鐵凋亡治療的病人,這是非常好的一個突破,因為目前單以腫瘤細胞PD-L1免疫反應對於篩選病人接受免疫治療仍不夠準確。該研究也提供了一個很好的資料庫,幫助其他相關領域的學者進一步研究這些轉錄體中其他的基因群參與免疫療法的機制。
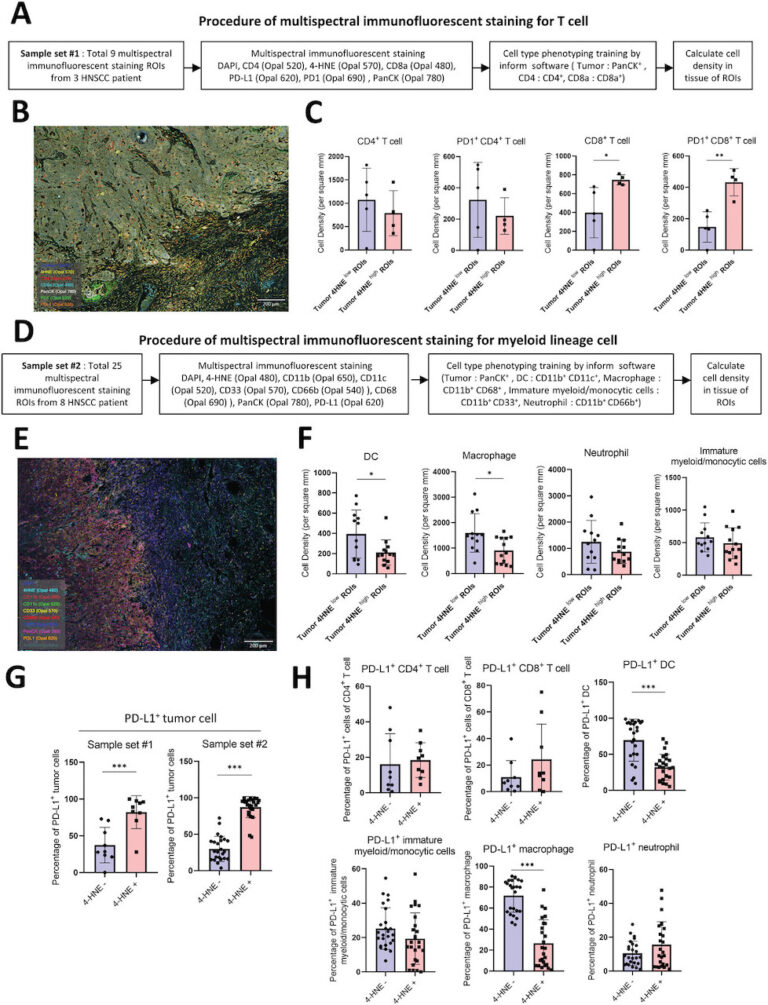
- 這份研究有哪些推論的限制?
楊慕華研究團隊在前臨床實驗動物模型使用頭頸癌病人原代培養細胞和患者原始移植腫瘤,在實驗鼠先進行鐵凋亡誘導劑再給予PD-L1抗體治療,未來可以微調鐵凋亡誘導劑和PD-L1治療的劑量、頻率以及給藥次序。
不過這些人類腫瘤細胞培養並不能在正常免疫老鼠上進行研究,因此未來需進行「擬人化小鼠」(humanized mice,小鼠的免疫系統已被置換為人類免疫系統)的研究,更精確評估進入臨床試驗的潛力。另外,鐵凋亡是否誘導其他轉錄因子與蛋白質後修飾來調節PD-L1表現也是值得研究的課題。
- 一般大眾應如何理解,這份研究對目前頭頸癌在免疫治療的發展影響?以及未來是否可能應用在其他的癌別?不同的癌症分期是否也能獲得不錯的治療效果?
目前免疫療法對頭頸癌、肺癌、食道癌的反應率只有20%左右。本研究的多重癌組織標誌可幫助篩選適合進行鐵死亡治療合併免疫治療的患者,例如同屬於鱗狀細胞癌之食道癌與肺癌的未來應用是值得期待的。
2023年05月08日
國家衛生研究院癌症研究所研究員/粒線體暨免疫腫瘤微環境實驗室主持人 李岳倫
- 這份研究的重要性為何?
鐵凋亡是新型態的細胞死亡方式,顧名思義,鐵凋亡是與鐵相關的細胞死亡。細胞的死亡是來自鐵相關代謝所產生的「活性氧自由基」(ROS)增加,造成細胞膜的脂質的過氧化作用(lipid peroxidation)。鐵凋亡不僅會引起鐵代謝紊亂,同時還會導致大量細胞膜脂質過氧化產物的堆積,進而誘導細胞死亡。
這份研究新發現,鐵凋亡相關的氧化壓力訊號會誘導免疫抑制點蛋白(PD-L1)的表現,表示此環境壓力與免疫調節有關。作者進一步發現,誘導癌細胞鐵凋亡可以增強免疫治療的效果。
其原理牽涉所謂的「免疫原性細胞死亡」(Immunogenic cell death, ICD);免疫原性細胞死亡的特徵是細胞在遭受壓力、或是治療時,產生細胞死亡而釋放出某些抗原蛋白,可以被抗原呈現細胞(antigen-presenting cells, APC)被辨識,然後引發免疫反應。未來可協同癌細胞鐵凋亡誘導劑以抑制腫瘤的生長,並增強anti-PD-L1免疫治療,提供有潛力的癌症聯合治療策略。
- 這份研究有哪些推論的限制?
目前已知「活性氧自由基」在疾病發生過程中扮演雙面刃的角色。在癌細胞中,因為活性氧的大量上升導致癌細胞凋亡,並且活化下游路徑,使抗原分泌於腫瘤微環境中,讓免疫細胞辨識;但是同時過多的活性氧在腫瘤微環境中又會削弱或是抑制誘導的免疫反應,使得T細胞在腫瘤微環境中失去功能。
因此,要如何使癌細胞成為抗原呈現細胞而引發免疫反應,並且維持腫瘤微環境中免疫細胞的正常功能,是當前所急需解決的問題。雖然細胞鐵凋亡增加免疫反應的研究,在細胞、動物試驗相當的成功,但是在人體內是否能引發抗腫瘤的免疫效果,仍需進一步的臨床試驗。
- 一般大眾應如何理解,這份研究對目前頭頸癌在免疫治療的發展影響?以及未來是否可能應用在其他的癌別?不同的癌症分期是否也能獲得不錯的治療效果?
若未來在頭頸癌能增強免疫治療的效果,對病人是一大福音,目前頭頸癌治療仍無有效的治療藥物及免疫治療藥物,另當然有可能應用在其他的癌症類別。個人會建議將免疫治療提前至較早癌症分期使用,會獲得較不錯的治療效果。
2023年05月08日
國立成功大學牙醫學系暨口腔醫學研究所講座教授 謝達斌
- 這份研究的重要性為何?
此一研究證明除了化療、放射線治療外的另一新癌症治療路徑:合併鐵凋亡治療可以增強免疫療法。開啟未來更有效治療癌症的新可能途逕。
- 這份研究有哪些推論的限制?
目前還沒有臨床應用鐵凋亡誘導劑於癌症治療領域,但已有研究確認已通過FDA許可的藥物如治療類風濕性關節炎的Sulfasalazine作用機制可誘導ferroptosis[1]。未來是否能結合免疫療法應用還需要臨床試驗證明。另外,癌細胞本身的多樣性也限制抗癌藥物能有效應用的對象,目前仍有待新生物標記的發現,來確認對此醫療法有效反應的癌症患者次群體。
- 一般大眾應如何理解,這份研究對目前頭頸癌在免疫治療的發展影響?以及未來是否可能應用在其他的癌別?不同的癌症分期是否也能獲得不錯的治療效果?
現階段頭頸癌治療方式也有Anti-PD-1免疫治療,能夠有效改善某些復發和轉移性癌症,但也僅有約20%至30%的頭頸癌患者能從免疫治療中獲得長期益處[2]。未來結合FDA已許可之鐵凋亡誘導劑來增強免疫療效若能得到進一步提升,讓更多比例的癌症患者受惠,則將是很重要的突破。但仍待通過臨床試驗來證明其臨床價值,但若需開發新的鐵凋亡誘導製劑來整合免疫療法,則因屬於合併治療類別,臨床許可路徑可能會更長。
我相信不同癌種之間雖然存在極大的病理機制的差異性,也可能有共通性存在。因此,鐵凋亡誘導製劑來整合免疫療法在其他種類癌症的應用是可以合理期待的。
引用文獻:
[1] Yu H, Yang C, Jian L, et al. Sulfasalazine‑induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor. Oncol Rep. 2019;42(2):826-838.
[2] Botticelli A, Cirillo A, Strigari L, et al. Anti-PD-1 and Anti-PD-L1 in Head and Neck Cancer: A Network Meta-Analysis. Front Immunol. 2021;12:705096.
版權聲明
本文歡迎媒體轉載使用,惟需附上資料來源,請註明新興科技媒體中心。
若有採訪需求或其他合作事宜,請聯絡媒體公關:
曾雨涵
02-3366-3366#55925
