SMC 資料庫
議題背景:
今(2023)年5月15日台北時間晚間23:00,國際期刊《自然醫學》(Nature Medicine)發表一篇由哥倫比亞麥德林安蒂奧基亞大學(University of Antioquia)神經科學組與哈佛醫學院的研究團隊所做的研究〈Resilience to autosomal dominant Alzheimer’s disease in a Reelin-COLBOS heterozygous man〉。
研究分析了來自哥倫比亞的 1,200 位有PSEN1 基因突變且因此容易得到罕見遺傳性阿茲海默症的人,從他們的臨床和遺傳數據中,找到一位哥倫比亞男性,發現雖然他有罕見遺傳性阿茲海默症相關的基因,大腦也有出現阿茲海默症的跡象,通常在40-50 歲時會開始影響認知能力,但這位男性卻在67 歲時才出現認知障礙。作者提到研究結果顯示,這位男性具有COLBOS突變基因,有可能限縮tau蛋白在大腦的聚集,而提供了抵抗遺傳性阿茲海默症認知障礙的效果。
這是全世界第二篇研究找到能抵抗遺傳性阿茲海默症認知障礙的基因,第一篇是由同一位研究主持人於2019年發表在《自然醫學》期刊,當時發現帶有APOECh基因突變的一位女性與家族中其他遺傳性阿茲海默症患者相較,較晚產生認知障礙。2019年研究的APOECh基因突變女性70歲才開始出現認知衰退,比家族中也帶有遺傳性阿茲海默症基因的人出現認知障礙的年齡(44歲),晚了20多年。
這些國外的研究案例為什麼重要? 對阿茲海默症病患與家屬可能有什麼幫助?有可能在台灣人身上找到這樣的基因嗎?台灣科技媒體中心邀請研究阿茲海默症病因,以及追蹤早期認知障礙和預測因子的專家解析此研究案例的重要性。
研究原文:
- Lopera, Francisco, et al. " Resilience to autosomal dominant Alzheimer’s disease in a Reelin-COLBOS heterozygous man." Nature Medicine. (2023). https://doi.org/10.1038/s41591-023-02318-3
專家怎麼說?
2023年05月14日
臺北榮民總醫院失智症治療及研究中心主任 王培寧
1. 過往也曾有一位女性帶有APOECh基因突變而有類似的抵抗認知障礙的能力,這份研究分析了第二位案例,這些研究為什麼重要?
有許多因素會影響基因在臨床上的表現以及症狀出現的時機。基因間存在著相互調控的機制,而環境因素也會影響基因和臨床症狀的表現。早期認為患有家族性阿茲海默症的患者,若攜帶致病的基因突變,就必然會發病,而且發病年齡在同一家族中大致相似。然而,這兩項研究告訴我們,即使攜帶這些極為重要的致病突變基因,仍可能受到其他因素的影響,導致發病年齡延遲。
這個最新案例顯示出阿茲海默症臨床症狀的發生年齡和嚴重程度,同時受到類澱粉蛋白和tau蛋白兩個因素的影響。在這個哥倫比亞的案例中,雖然大腦內類澱粉蛋白的沉積量與家族中的其他患者相比並不少,但是由於受到另一個基因的調控,其大腦內tau蛋白的沉積量明顯較少。這導致患者的發病年齡比家族中其他人晚了二十幾歲,直到70多歲才開始出現症狀,與一般晚發性阿茲海默症的發病年齡相近。
2. 研究有哪些推論上的限制?對阿茲海默症病患與家屬可能有什麼幫助?
研究的推論有主要三個限制,首先,雖然研究中利用動物實驗驗證了COLBOS突變基因可能的作用機制,但動物實驗中類澱粉蛋白的毒性與人類有差異,同時該基因仍可能受其他基因或環境因素的調節。
第二,此哥倫比亞男性患者的家族中,還有另一位帶有COLBOS突變基因的姐姐,但她的發病年齡比這位患者早,大約在六十幾歲時發病。儘管如此,她的發病年齡仍然比家族中其他人晚了十幾年。由此推測,這個基因可能具有一定的保護作用,但保護程度可能因個人而異。
導致這位女性患者發病年齡較此篇研究的男性患者早的另一個可能因素,是她在發病前曾因跌倒導致眼部受傷和骨折。由於需要接受手術治療,因此接受了全身麻醉。所以第三個限制是,如果這些因素(跌倒、骨折、視力影響、手術、全身麻醉)導致患者發病年齡提前,則環境因素對發病時機的影響仍然非常重要。
根據以上推論,即使攜帶失智症突變或危險基因,通過良好的努力促進健康、保持良好的生活方式仍然可以延遲疾病發生。
3. 台灣有人具有可能抵抗阿茲海默症病程的遺傳基因嗎?
當然,目前對於COLBOS突變基因在台灣人中的盛行率尚不清楚。同樣地,台灣人可能具有其他種類的保護性基因,能夠抵抗阿茲海默症的發生。
根據目前的研究,阿茲海默症的發病受到多種基因和環境因素的影響。因此,在台灣人口中可能存在著不同的基因變異和保護機制,對於疾病發展具有重要作用。然而這些具體基因變異和保護因子的盛行率和功能,仍然需要進一步的研究。
2023年05月15日
陽明交通大學腦科學研究所副教授 鄭菡若
陽明交通大學腦科學研究所助理 洪維謙
阿茲海默症是一種造成老年失智的主因,所以過去研究多專注於導致提早發病的基因突變上,這些顯性遺傳[註一]突變僅存在於幾百個家族中,常出現於APP、PSEN1、PSEN2基因上,其中,PSEN1與PSEN2這兩個基因產物會製造出類澱粉蛋白,切出不同長度的Aβ(讀音Abeta),Aβ累積成斑塊而造成早發性阿茲海默症。
PSEN1 E280A基因突變族群是世界最大的遺傳性阿茲海默症家族,含有超過1200位患者,特徵是病程進展快速,男性進展成輕度認知障礙的常見年齡為44歲,女性為49歲[1] 。本篇研究是從帶有早發性突變(PSEN1 E280A)的家族中找到一位帶有RELN H3447R突變基因(命名為RELN-COLBOS突變)的男性患者,直到67歲才出現輕度認知障礙,比其他PSEN1 E280A突變族群晚了20年(圖一),但病程進展速度類似。因此本文認為RELN-COLBOS突變讓原本應該是早發性阿茲海默症的人延緩發病。
RELN 基因的產物是一個與神經發育疾病有關的Reelin蛋白,雖有部分動物實驗證實Reelin蛋白可以減少Aβ和Tau蛋白的聚集[2][3],但之前受關注的程度並不高,且臨床數據有限,也沒有針對此蛋白的藥物發展。本研究提供了臨床上證明可延緩阿茲海默症發病的機制,對於預防策略的發展有很大的幫助。
要找到這種延緩發病的突變基因,機率非常低,必須從人數眾多、臨床資料完整且長期追蹤的家族中篩選,這是全世界第二篇。同個團隊在2019年發表的第一個保護性基因突變- APOECh [4],必須是兩個APOE基因都帶有一樣的突變,才可延緩PSEN1 E280A突變所引起的早發性阿茲海默症,但RELN-COLBOS只要兩個RELN基因之一個帶有H3447R突變就可延緩PSEN1 E280A突變所引起的早發性阿茲海默症。
APOECh跟RELN-COLBOS這兩個患者的腦中都有廣泛的Aβ沉積,高於一般PSEN1 E280A族群,但多數腦區的Tau病變則較少,其中,RELN-COLBOS基因男性患者的腦神經密度比APOECh或PSEN1 E280A突變患者高,可能因此使得認知障礙較晚出現。從這個RELN-COLBOS男性患者的女性近親與動物實驗的近一步研究發現,RELN-COLBOS基因延緩阿茲海默症在男性的作用可能優於女性。不過目前已知的保護性基因案例太少,這兩個保護性基因突變研究都是在帶有PSEN1 E280A突變的族群中找到,只能提供假說的建立,並不確定是否適用於所有的患者,必須累積更多的資料與研究。
台灣人是否有此基因突變尚不清楚,可以驗證的方式為利用現有資料庫再去針對RELN基因進行分析。基因研究的基礎需要完整臨床資料的基因定序資料庫,如台灣精準醫療計畫、台灣人體資料庫等。但台灣有完整家族病史的樣本數不夠多,有待精準醫療計畫的執行,如果主管機關與患者及其家屬積極參與基因資料庫的建立,我們有機會更瞭解本土的阿茲海默症家族,近一步找到最佳的治療方法,這些研究將有助於發展高專一度藥物、診斷準確性與治療策略的發展。
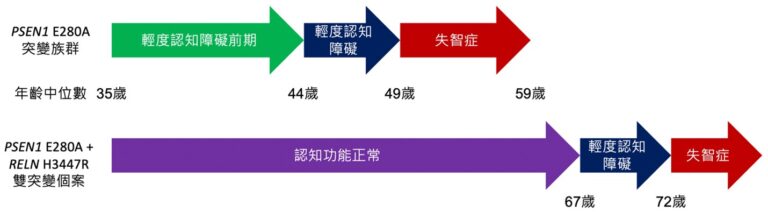
圖一:帶有PSEN1 E280A 突變族群與有 PSEN1 E280A + RELN H3447R 雙突變(RELN-COLBOS突變)個案的病程比較
2023年05月15日
中央研究院細胞與個體生物學研究所研究員 廖永豐
1. 過往也曾有一位女性帶有APOECh基因突變而有類似的抵抗認知障礙的能力,這份研究分析了第二位案例,這些研究為什麼重要?
首先,這兩位案例都顯示,即便腦中類澱粉蛋白(Amyloid-beta)病理沈積物累積過量時,神經細胞仍然有能力可以抵擋其引發的神經毒性。第二層意義是從「類澱粉蛋白假說(Amyloid Cascade Hypothesis)」的致病機轉角度,Tau蛋白的確是受到類澱粉蛋白的神經毒性刺激而形成神經纖維糾結(Neurofibrillary tangles)的病理沈積物。第三層意義則是,目前還在研發以清除Tau蛋白沈積物為治療策略的藥物,若研究後續進一步發展,會大大提高未來臨床試驗能成功延緩神經細胞凋亡、認知功能退化的可能性。
這兩項研究成果也表示,未來可以針對這兩個可抵抗類澱粉蛋白神經毒性的突變蛋白質APOE3ch及Reelin-COLOBS,開發能活化在神經細胞中控制訊息傳遞機轉的治療方法,強化神經細胞自身抵禦類澱粉蛋白神經毒性的效果。未來將有機會開發更多能應用於預防阿茲海默症發病或延緩阿茲海默症病程演進的藥物。
2. 研究有哪些推論上的限制?對阿茲海默症病患與家屬可能有什麼幫助?
目前因為只有這兩位案例,仍然無法推論是否有APOE3ch突變基因或是Reelin-COLOBS突變基因的人一定都可以抵禦類澱粉蛋白的神經毒性。雖然這篇最新案例的研究有使用Tau蛋白沈積的基因轉殖小鼠,將老鼠的Reelin基因序列替換為人類的Reelin-COLOBS突變基因序列,結果的確可以減少Tau蛋白的堆積,還可延緩此Tau蛋白基因轉殖小鼠的神經退化病程,並改善小鼠的運動功能。但這些結果是否都由Reelin-COLOBS突變基因產生的蛋白質獨自引發的神經保護效應,仍然需要更多研究分析才能確定。
至於對阿茲海默症病患與家屬,主要是在與家庭醫師做遺傳諮詢時,可以考慮是否要加做針對APOE3ch基因Reelin-COLOBS基因的定序檢測,檢測結果或可提供醫師以更接近個人化醫療的形式,評估病患病程演進及家屬得病的風險。未來若能有APOE3ch或Reelin-COLOBS突變蛋白質功能的藥物被研發成功,對病患在延緩阿茲海默症病程演進,及對家屬在預防阿茲海默症發病,將有莫大的幫助。
3. 台灣有人具有可能抵抗阿茲海默症病程的遺傳基因嗎?
目前台灣人族群基因體學還沒有針對阿茲海默症有相關的研究。或許可考慮利用國家型計畫中臺灣人體生物資料庫(Taiwan Biobank)裏收集到有遺傳性阿茲海默症病史的樣本,看看是否有發病年齡比預期晚很多年的樣本,再將這些樣本做全基因體基因序列定序,再進一步比對分析,也許有機會找出台灣人特有能抵擋阿茲海默症病程的遺傳基因特異性序列,或是確認是否有已知與這篇研究案例一樣能抵抗阿茲海默症病程的遺傳基因。
2023年05月15日
國立成功大學細胞生物與解剖學研究所教授 郭余民
1. 過往也曾有一位女性帶有APOECh基因突變而有類似的抵抗認知障礙的能力,這份研究分析了第二位案例,這些研究為什麼重要?
這兩個案例皆是哈佛醫學院Yakeel T. Quiroz教授主持的研究,他們多年來追蹤一群住在南美洲哥倫比亞一小鎮內約1,200位的居民。這群人來自同一祖先,家族遺傳都帶有相同的PSEN1(E280A) 突變基因。多年累積的統計資料顯示,他們約在44歲左右開始出現輕度認知障礙,近50歲時會被診斷為阿茲海默症。
同樣由Yakeel T. Quiroz教授主導的研究在2019年發現這群人中有幾位特例,一位女性雖然帶有PSEN1(E280A) 突變基因,卻遲至70多歲時才開始出現認知障礙[4]。2019年經分析後發現這位女性還帶有另一個APOECh突變基因,不像大部分的基因突變會導致疾病,反而延緩遺傳性阿茲海默症的發病將近30年。
本次研究中發現的第二個突變基因取名為RELN-COLBOS,代表是RELN基因發生突變,同時註明是哥倫比亞(COLombia)和波士頓(BOSton)哈佛大學共同合作所發現。這個突變發生在一位帶有PSEN1(E280A) 基因突變的男性,他在將近70歲時才開始出現認知障礙。研究作者比較分析這兩個案例的大腦後發現他們有一些共同點,這兩個案例大腦中澱粉樣蛋白斑塊的累積量,跟其他帶有PSEN1(E280A) 基因突變且49歲就出現失智症狀的親戚比起來較高,但是在阿茲海默症關鍵腦區的神經纖維纏結累積程度,卻遠低於帶有PSEN1(E280A) 突變基因的親戚,神經退化的情況非常輕微,幾乎跟正常人一樣。
先前的科學已指出阿茲海默症病理過程中,三個關鍵特徵的順序分別是最早澱粉樣蛋白(Amyloid)聚集形成斑塊,接著,Tau蛋白聚集形成神經纖維纏結,最後是神經元死亡和腦組織萎縮的神經退化(Neurodegeneration)。此篇研究與2019年研究中,兩個案例的遺傳性阿茲海默症停留在最早的澱粉樣蛋白聚集階段將近30年,才進入較晚的兩個階段。
作者深入研究後發現,這兩個突變基因產生的蛋白質雖然作用機制不同,但是卻有一共通點,都會減少或干擾一種和血脂代謝與脂肪運輸有關的E型載脂蛋白(apolipoprotein E)。本篇作者認為,若能模擬這兩個突變基因在阿茲海默症關鍵腦區的作用機制,或許可將阿茲海默症高風險的患者病情停留在早期階段。可為開發阿茲海默症藥物找到一個關鍵的契機。
2. 研究有哪些推論上的限制?對阿茲海默症病患與家屬可能有什麼幫助?
上述兩個研究案例都帶有PSEN1(E280A) 突變基因,會快速進入阿茲海默症早期階段。但是絕大多數的阿茲海默症患者並沒有攜帶會導致家族遺傳的突變基因,一般患者從早期進展到晚期阿茲海默症的病理過程,與研究案例中帶有遺傳致病基因突變的患者,病理進程不同。
再者,由於本研究只比較兩個案例和少數幾位帶有PSEN1(E280A) 基因突變的親戚,因此不應推論到所有的阿茲海默症病患。最後,本研究所看到延緩認知障礙的作用有可能是源自於其他因素例如其他基因突變等,而非僅是RELN-COLBOS基因突變的結果。因此若要將此研究的推論延伸至非家族遺傳的阿茲海默症患者,需要更多研究來支持。
這位帶有RELN-COLBOS突變基因的男性其實有位姊姊也有同樣的突變基因,雖然她也因此延緩了產生認知障礙的時間,但是延緩時間比弟弟短。研究作者認為這可能和姊姊經歷過嚴重頭部受傷有關。此外,她還有憂鬱症和甲狀腺機能低下的病史,這些因素都可能影響她的認知功能表現。也還待研究是否性別會影響RELN-COLBOS突變基因延緩遺傳性阿茲海默症的作用。
但無論如何,這兩個案例都指出,是有機會延緩遺傳性阿茲海默症疾病進程的。除了本研究指出延緩從早期進入晚期病程的可能機制,許多生活習慣和環境因素亦已被證實可強化大腦,延緩進入晚期阿茲海默症。由肯塔基大學研究人員主持的長期追蹤美國中西部天主教修女的研究發現,許多修女的大腦中有大量的類澱粉蛋白與Tau蛋白,然而他們生前的認知功能卻都正常[5]。這個研究顯示,我們雖然無法控制大腦阿茲海默症的病理程度和解剖位置,但是可透過一些手段如運動、動腦、地中海式飲食等強化大腦來抵抗、延緩阿茲海默症病程。
3. 台灣有人具有可能抵抗阿茲海默症病程的遺傳基因嗎?
本研究是基於一群都帶有PSEN1(E280A) 突變基因的親人,這是舉世僅有的特有族群。因為他們的疾病進程非常類似,所以容易挑出不一樣的患者。帶有其他突變基因的人,即使都是PSEN1基因發生突變,阿茲海默症病程的差別會很大,很難看出與眾不同之處。
在台灣,由於全基因定序費用頗高,因此臨床的做法是先觀察到早發性阿茲海默症,才會分析基因,追查是否與基因突變有關。70歲才發病的病人一般不會定序全基因。因此,即使台灣人具有可能抵抗阿茲海默症病程的特有遺傳基因,也不容易找出。需要特別研究數量夠多的台灣人基因序列,或許有機會了解是否有台灣人帶有APOE和RELN此二個可抵抗阿茲海默症病程的基因。
參考文獻:
[註一] 顯性遺傳指的是,只要一對染色體上,其中一個基因有突變,即使另一個同樣位置的基因正常,這個突變產生的特徵就會表現出來。相對的,隱性遺傳是指成對染色體中,兩個相同位置的基因都有突變,才能表現出特徵。
[1] N. Acosta-Baena et al., Pre-dementia clinical stages in presenilin 1 E280A familial early-onset Alzheimer's disease: a retrospective cohort study. Lancet Neurol10, 213-220 (2011).
[2] S. Kocherhans et al., Reduced Reelin expression accelerates amyloid-beta plaque formation and tau pathology in transgenic Alzheimer's disease mice. J Neurosci30, 9228-9240 (2010).
[3] L. Pujadas et al., Reelin delays amyloid-beta fibril formation and rescues cognitive deficits in a model of Alzheimer's disease. Nat Commun5, 3443 (2014).
[4] J. F. Arboleda-Velasquez et al., Resistance to autosomal dominant Alzheimer's disease in an APOE3 Christchurch homozygote: a case report. Nat Med25, 1680-1683 (2019).
[5] Snowdon DA; Nun Study. Healthy aging and dementia: findings from the Nun Study. Ann Intern Med. 2003 Sep 2;139(5 Pt 2):450-4. doi: 10.7326/0003-4819-139-5_part_2-200309021-00014. PMID: 12965975.
版權聲明
本文歡迎媒體轉載使用,惟需附上資料來源,請註明台灣科技媒體中心。
若有採訪需求或其他合作事宜,請聯絡我們:
曾雨涵
02-3366-3366#55925
