SMC 資料庫
背景介紹
2020年2月11日,世界衛生組織(WHO)於日內瓦召開的會議中,WHO宣布將「2019新型冠狀病毒」的疾病名,正式命名為「COVID-19」。國際病毒學分類學會(International Committee on Taxonomy of Viruses, ICTV)正式命名病毒為Severe Acute Respiratory Syndrome coronavirus 2(SARS-CoV-2)[1][2]。
疫情開始從中國蔓延到全球,一名35歲男性在1月15日從中國武漢探親返回美國華盛頓州後,確診感染了新型冠狀病毒,在住院期間陸續出現了持續性乾咳、噁心、嘔吐,在發病後的第9天發展成肺炎。
患者在發病後的第11天晚上,接受了尚在人體臨床試驗階段的抗病毒藥物「瑞德西韋」治療後,在第11天與第12天分別採檢鼻咽、口咽樣本的結果顯示,病毒數量有減少的趨勢,第12天採檢的口咽樣本呈現陰性。1月31日,此臨床案例的處置流程也發表在《新英格蘭醫學期刊》(The New England Journal of Medicine)的研究報告,至此瑞德西韋作為治療新型冠狀病毒用藥開始備受重視。[3]
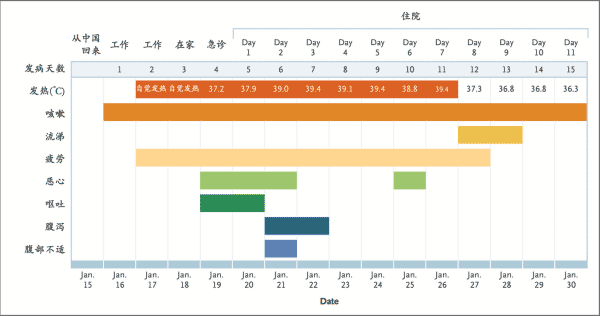
圖1. 按照患者發病及住院日期(2020年1月16日至2020年1月30日)列出的症狀和最高體溫。[3]
最初由美國吉利德科學公司(Gilead Sciences, Inc.)開發的瑞德西韋,原先是用來治療伊波拉病毒患者的抗病毒藥物,從2018年10月25日開始人體臨床試驗階段,直至2019年10月21日來到人體試驗的第三期[4],是第一個還未正式上市就討論度極高的抗「新型冠狀病毒」藥物。
瑞德西韋是尚在試驗階段的廣效型(broad-spectrum)抗病毒藥物。新藥在開發成上市藥物之前的研究期,需要完成許多工作,通常分為研究藥物的分子機制與動物試驗的「臨床前試驗」,包括藥物在細胞、動物實驗階段的安全性與確認效果、藥物的作用機轉,完成後才會進入技術轉移,而後進入人體臨床試驗。
人體臨床試驗基本概念
早前瑞德西韋在治療伊波拉患者的臨床試驗已進入人體試驗的第三期,加速了新型冠狀病毒的臨床試驗階段。新藥研發的過程需先申請人體臨床試驗(Investigational New Drug,IND),才能進行臨床分期試驗(PhaseⅠ、Ⅱ、Ⅲ和Ⅳ期),第三期臨床試驗過程中若證實藥物療效,可申請新藥上巿許可(New Drug Application,NDA)。[5][6][7]第四期臨床試驗是藥品上市後的追蹤。
第一期臨床試驗(Phase I,人體藥理研究):
第一期即是首次在人體上試驗藥品。受試者為數名或十數名健康志願者,若癌症疾病則為少數病人參與,主要是瞭解藥物的安全劑量,和人體能承受藥物的最高劑量,此階段通常在特定的臨床試驗病房中,由有經驗的醫師來執行。
第二期臨床試驗(Phase II,治療探索):
第二期的臨床試驗先嚴格篩選出一群同質性高的病人,探索藥物的療效和安全性,為少數病人的臨床試驗,一般為數十人,再根據該試驗結果來設計第三期臨床試驗的受試者人數。
第三期臨床試驗(Phase III,治療確認):
此階段受試者對象較多,為大型的臨床試驗,受試者人數可能由數百到數千人不等,在設計上一般以隨機分配、雙盲及對照試驗等方式進行,主要證實藥物療效及安全性,作為上市前的依據。
第四期臨床試驗(Phase IV,治療使用):
這個階段是藥品上市後的追蹤,且與已核准的適應症相關,監測該藥物是否有先前幾個階段沒發現的副作用或是不良反應,試驗設計較為簡單,但是需要長時間觀察大量的病人。
瑞德西韋的人體臨床試驗(Clinical trials)
近日(2020/03/15)新增的一項大型跨國人體臨床試驗計畫
此項計畫於2020年3月15日由吉利德公司主導,試驗地區包含美國、香港、韓國、新加坡以及台灣,台灣合作試驗醫院為台灣大學醫學院附設醫院,比較中度新冠肺炎患者在照護標準下與兩種使用瑞德西韋治療方針的安全性與抗病毒效果,預計在今年五月完成此項臨床試驗案。[8]
試驗計畫名稱:A Phase 3 Randomized Study to Evaluate the Safety and Antiviral Activity of Remdesivir (GS-5734™) in Participants With Moderate COVID-19 Compared to Standard of Care Treatment
臨床試驗編號(ClinicalTrials.gov Identifier):NCT04292730
實際研究起始日:2020年3月15日
預計完成日:2020年5月
試驗委託方:美國吉利德科學公司(Gilead Sciences, Inc.)
資訊提供方:美國吉利德科學公司(Gilead Sciences, Inc.)
階段:第三期人體臨床試驗驗(Phase Ⅲ)
預估納入試驗人數:600人
分配:隨機
盲性:開放式試驗(Open-label)
在以上所新增的大規模試驗之前,瑞德西韋的這款藥物就在全世界進行了多項人體臨床試驗,其中規模最大的兩項試驗如下,以評估確診為新型冠狀病毒肺炎的成年人,使用瑞德西韋的安全性和有效性。從2020年3月開始,這兩項第三期臨床研究在亞洲國家與其他診斷病例多的國家之醫療中心,總共招募約1,000名患者。[9][10][11]
以下介紹這兩項主要臨床試驗:
第一項的試驗計畫名稱為:A Multicenter, Adaptive, Randomized Blinded Controlled Trial of the Safety and Efficacy of Investigational Therapeutics for the Treatment of COVID-19 in Hospitalized Adults
圖2. 現行以瑞德西韋治療新型冠狀病毒肺炎藥物的人體臨床試驗
第一項由美國國家過敏與傳染病研究院(NIAID)負責,試驗地區主要以美國本土為主。首次參與試驗的是一名美國人,他在日本橫濱停靠的鑽石公主號遊輪上被隔離後遣返,並自願參加了這項研究。該研究可用於評估其他研究治療方法,並招募美國和世界其他地區的參與試驗者。[9]
臨床試驗編號(ClinicalTrials.gov Identifier):NCT04280705
實際研究起始日:2020年2月21日
預計完成日:2023年4月1日
試驗委託方:隸屬美國國家衛生研究院(NIH)的美國國家過敏與傳染病研究院(NIAID)
資訊提供方:美國國家過敏與傳染病研究院
期程(Phase):第二期人體臨床試驗驗(Phase Ⅱ)
預估納入試驗人數(Estimated Enrollment):394人
分配(Allocation):隨機(Randomized)
盲性(Masking):雙盲,受試者、研究人員(Participant, Investigator)
第二項共有兩個試驗計畫,皆是吉利德公司與中國大陸的衛生部門共同合作,對感染新型冠狀病毒患者進行的臨床試驗,測試瑞德西韋作為新型冠狀病毒的潛在治療方法之安全性和有效性。這兩個試驗計畫皆由中日友好醫院負責,並在湖北省的多個地點開始試驗。吉利德公司免費提供研究藥物、研究設計和行為方面的意見。[10][11]
第一個試驗計畫為評估已出現嚴重臨床表現的確診患者(NCT04257656)。第二個試驗計畫為評估已住院但未有明顯疾病臨床表現(如需氧量)的確診患者(NCT04252664)。第一個試驗計畫於2月6日開始招募患者。第二個試驗計畫於2月13日開始招募患者。臨床試驗結果預計將於4月開始陸續公布。
試驗計畫名稱:A Phase 3 Randomized, Double-blind, Placebo-controlled, Multicenter Study to Evaluate the Efficacy and Safety of Remdesivir in Hospitalized Adult Patients With Severe 2019-nCoVRespiratory Disease.
臨床試驗編號(ClinicalTrials.gov Identifier):NCT04257656
實際研究起始日:2020年2月6日
預計完成日:2020年5月1日
試驗委託方:首都醫科大學(Capital Medical University)
資訊提供方:曹斌,中日友好醫院(Bin Cao, China-Japan Friendship Hospital)
期程:第三期人體臨床試驗(Phase Ⅲ)
預估納入試驗人數:453人
分配:隨機
盲性:四盲,受試者、醫療人員、研究人員、成效評估者(Participant, Care Provider, Investigator, Outcomes Assessor)
試驗計畫名稱:A Phase 3 Randomized, Double-blind, Placebo-controlled Multicenter Study to Evaluate the Efficacy and Safety of Remdesivir in Hospitalized Adult Patients With Mild and Moderate 2019-nCoV Respiratory Disease.
臨床試驗編號(ClinicalTrials.gov Identifier):NCT04252664
實際研究起始日:2020年2月12日
預計完成日:2020年4月27日
試驗委託方:首都醫科大學
合作單位:中國醫學科學院(Chinese Academy of Medical Sciences)
資訊提供方:曹斌,中日友好醫院
階段:第三期人體臨床試驗驗(Phase Ⅲ)
預估納入試驗人數:308人
分配:隨機
盲性:四盲,受試者、醫療人員、研究人員、成效評估者
補充:以下介紹瑞德西韋在啟動人體試驗階段前,完成的臨床前分子機制試驗和臨床前動物試驗。
臨床前試驗(Pre-clinical toxicological tests):分子機制
2019年4月4日發表在《病毒期刊》(Viruses)的「Mechanism of Inhibition of Ebola Virus RNA-Dependent RNA Polymerase by Remdesivir」與2020年2月24日發表在《生物化學期刊》(The Journal of Biological Chemistry)的「The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus」兩篇研究報告,指出瑞德西韋在多項細胞與動物研究中顯示,對多種RNA病毒具有廣泛的抗病毒效果,包括SARS病毒、MERS病毒和伊波拉病毒(Ebola virus, EBOV),更充分說明了瑞德西韋抗病毒的作用機制[12] [13]。
當RNA病毒進入宿主細胞內,以自身的RNA序列當作複製模板,利用自帶的RNA聚合酶(RNA-dependent RNA polymerase, RdRp),以細胞內的核苷三磷酸(Nucleoside triphosphate, NTP)作為材料,合成新的RNA。
瑞德西韋作為一種腺苷核苷酸類似物(adenosine nucleotide analogue)的前體藥物(prodrug),前體藥物是指瑞德西韋在進入細胞後,會被細胞磷酸化成Remdesivir-TP,磷酸化的瑞德西韋(Remdesivir-TP)結構類似被病毒作為材料的三磷酸腺苷(adenosine triphosphate, ATP),可有效取代ATP插入到新合成的RNA中,會發生延遲的複製終止(delayed chain termination),最終成功阻斷RNA的複製。[12][13]
近日(2020年2月4日)亦有研究發現,瑞德西韋和氯喹(chloroquine)在Vero E6細胞實驗中,都能有效抑制2019新型冠狀病毒(COVID-19)的病毒活性。[14]
臨床前試驗(Pre-clinical toxicological tests):動物試驗
2017年8月23日發表在《科學轉譯醫學》(Science Translational Medicine)的「Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses」研究報告,從人類上皮細胞株2B4的實驗結果看到,瑞德西韋可有效抑制SARS與MERS冠狀病毒在人類上皮細胞的複製能力,在SARS發病小鼠實驗的切片染色結果顯示,預防性投藥(prophylactic)與早期治療(early therapeutic)可顯著降低小鼠肺部的病毒載量(lung viral load),並改善臨床表徵與肺部功能。[15]
近期(2020年1月10日)一篇發表在《自然通訊》(Nature Communications)的「Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV」研究報告,研究者使用瑞德西韋與抗愛滋病毒用藥(洛匹那韋/利托那韋[lopinavir/ritonavir]),分別合併干擾素-β(interferon beta)在小鼠身上後,研究藥物治療已感染MERS冠狀病毒小鼠的成效。
研究中先呈現細胞實驗的結果,相較於洛匹那韋/利托那韋合併干擾素-β,瑞德西韋合併干擾素-β具有更好的抗病毒能力;在MERS發病小鼠實驗中,顯示瑞德西韋的預防性投藥(prophylactic)減少了病毒複製數量與急性肺損傷(acute lung injury, ALI)。並在瑞德西韋的治療性投藥實驗中改善了肺部功能與降低急性肺損傷,而在洛匹那韋/利托那韋合併干擾素-β的治療性投藥則未能降低急性肺損傷。[16]
上述這些細胞、動物試驗與少數人體臨床個案的研究數據,提供了實質性證據,展現瑞德西韋抑制RNA冠狀病毒與2019新型冠狀病毒的效果,由於瑞德西韋已在早期臨床研究中證明對人體具有安全性,表示瑞德西韋可能作為有效抵抗MERS、流行於人類的冠狀病毒,甚至是治療2019新型冠狀病毒(COVID-19)的藥物,近期美國與中國已開始多項人體臨床試驗,測試瑞德西韋治療新型冠狀病毒患者的效果。[14][15]
引用來源:
1. Naming the coronavirus disease (COVID-19) and the virus that causes it
2. International Committee on Taxonomy of Viruses ICTV
3. Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States. N Engl J Med. 2020 Jan 31. doi: 10.1056/NEJMoa2001191
4. Investigational Therapeutics for the Treatment of People With Ebola Virus Disease
5. Gilead Sciences: Pipeline
6. Gilead Sciences Update On The Company’s Ongoing Response To COVID-19
7. Warren, Travis K., et al. “Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys.” Nature 531.7594 (2016): 381-385.
8. Study to Evaluate the Safety and Antiviral Activity of Remdesivir (GS-5734™) in Participants With Moderate Coronavirus Disease (COVID-19) Compared to Standard of Care Treatment
9. Adaptive COVID-19 Treatment Trial
10. Severe 2019-nCoV Remdesivir RCT
11. Mild/Moderate 2019-nCoV Remdesivir RCT
12. Tchesnokov, Egor P., et al. “Mechanism of inhibition of Ebola virus RNA-dependent RNA polymerase by remdesivir.” Viruses 11.4 (2019): 326.
13. Gordon, Calvin J., et al. “The antiviral compound remdesivir potently inhibits RNA-dependent RNA polymerase from Middle East respiratory syndrome coronavirus.” Journal of Biological Chemistry (2020): jbc-AC120.
14. Wang, Manli, et al. “Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro.” Cell research 30.3 (2020): 269-271.
15. Sheahan, Timothy P., et al. “Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses.” Science translational medicine 9.396 (2017).
16. Sheahan, Timothy P., et al. “Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV.” Nature Communications 11.1 (2020): 1-14.
17. isirv Antiviral Group: Bin Cao
18. 新型冠狀病毒(SARS-CoV-2)感染臨床處置暫行指引
19. Harrison, C. “Coronavirus puts drug repurposing on the fast track.” Nature Biotechnology (2020).
版權聲明
本文歡迎媒體轉載使用,惟需附上資料來源,請註明台灣科技媒體中心。
若有採訪需求或其他合作事宜,請聯絡我們:
台灣科技媒體中心
02-77095375
